发布时间:2024-09-25
皮肤作为人体最大的器官和屏障,在调节宿主面对病原微生物的免疫反应中发挥作用。皮肤组成结构紧凑,表皮(epidermis)由多层上皮细胞构成,内部包含不断增殖的角质细胞和分布其中的免疫细胞群体,如朗格汉斯细胞(Langerhans cells),是皮肤特化的巨噬细胞。表皮向内深入是真皮层,存在由免疫细胞组成的网络结构【1】。皮肤内几乎所有细胞在接受特定的刺激下,都可以分泌细胞因子和趋化因子,活化固有免疫细胞和适应性免疫细胞,并招募外周血内白细胞驻留于皮肤;同样,外周血循环Treg细胞表面也普遍存在向皮肤归巢的标记物,提示这些Treg理论上可组成性驻留于皮肤组织。
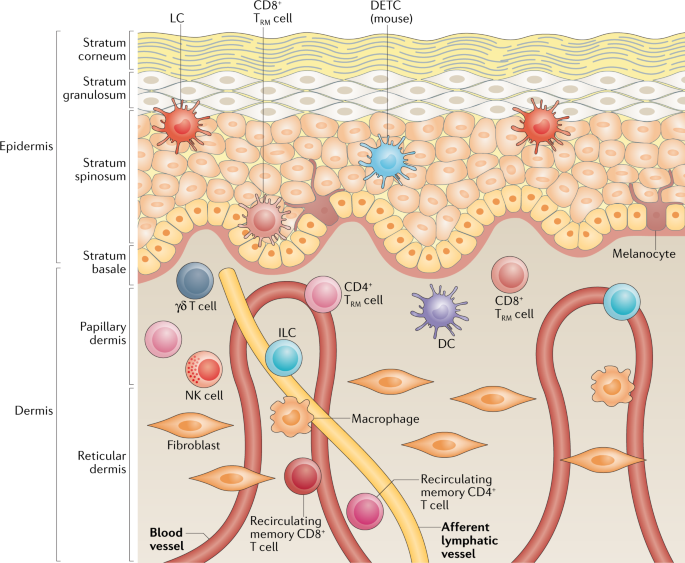
皮肤驻留T细胞及表型
皮肤驻留T细胞作为独立T细胞群体引发学者关注始于2000年,发现将银屑病人的健康皮肤移植到免疫缺陷小鼠身上,小鼠也表现出银屑病的表型,提示”病原性T细胞”预先已存在于“健康“的皮肤内【2】。后来有研究量化皮肤内记忆T细胞的数量是外周血液内数量的4倍,且表型分析发现这些记忆T细胞大多类似Treg细胞,可大量分泌IFNγ,IL-17和IL-13等细胞因子【3】。
分析由皮肤分离而来的Treg细胞表型和功能,也获得了许多有趣的发现:与固有层内驻留Treg主要为pTreg的特性不同,皮肤内80% Treg主要为表达GATA3和Nrp1-Helios的胸腺来源tTreg细胞【3】。成人皮肤几乎所有Treg细胞都为CD45RO阳性,几乎不表达CD45RA;但胎儿期皮肤中的表型则刚好相反。成人皮肤中Treg高表达有与记忆T细胞相关的标记物,如CD27和 BCL‑2;与皮肤内的效应记忆T细胞(effector memory T cells)比较发现,记忆Treg细胞表达独特的T细胞受体序列但不表达CC-趋化因子受体CCR7 ,因此在体条件下无法迁移出皮肤。这些结果都进一步说明,成年皮肤中Treg细胞具有记忆效应细胞的表型,可以识别独特的抗原,且能稳定驻留于皮肤组织内【4】。
皮肤正常功能离不开Treg
组织修复是皮肤的核心功能之一,皮肤驻留Treg通过表达表皮生长因子受体,促进了Treg细胞在损伤部位聚集并调控炎性因子分泌细胞的积累,发挥促进组织损伤后的修复功能【5】。皮肤的另一个重要生理功能是维持毛囊发生,这一功能也是通过Treg细胞促进皮肤干细胞的增殖和分化发挥功能的【6】。事实上,毛囊也恰恰是Treg细胞乐于积累的部位。有趣的现象发生了:同样是Treg细胞,同样是屏障结构,但Treg在皮肤则促进干细胞向皮肤组成细胞的分化,在肠道则促进多能性维持和干细胞的自我更新,再次体现了组织对内驻留Treg细胞的表型塑造。皮肤驻留Treg功能正常受多种因素影响:
微生物群
微生物种群的存在对新生个体皮肤发育过程中Treg细胞的增殖发挥重要作用,有研究人员比较了分别于去除特定病原体(Specific pathogen-free)即SPF环境和完全无菌(Germ-free)环境下繁育的新生小鼠,完全无菌环境中的新生小鼠皮肤内Treg细胞数量显著缺乏。对比同一个体不同身体部位的皮肤,如躯体和耳部皮肤,其中所含Treg细胞含量也有明显差异。特殊菌群如痤疮丙酸杆菌(学名Propionibacterium acnes),可干扰皮肤内Treg细胞增殖并诱导吞噬细胞释放多种炎性介质诱导局部产生炎症反应,最终破坏皮脂腺形成痤疮。
紫外线的影响
皮肤是经常面临紫外线照射的器官,UVB已被证实存对皮肤内免疫抑制的功能【7】,临床上可见采用紫外照射治疗银屑病、特应性皮炎等多种皮肤病。UVB 照射可显著增加Nrp1+ tTreg 细胞的扩增,这是紫外引发免疫耐受的最主要机制。此外,皮肤接受紫外照射有助于膳食中的胆固醇衍生物转化为维生素D3,体外实验发现,CD4+ T细胞接受维生素D3作用可转化为Treg细胞;体外对朗格汉斯细胞给予维生素D3,可诱导其分泌大量的TGF-β,有助于Treg形成。
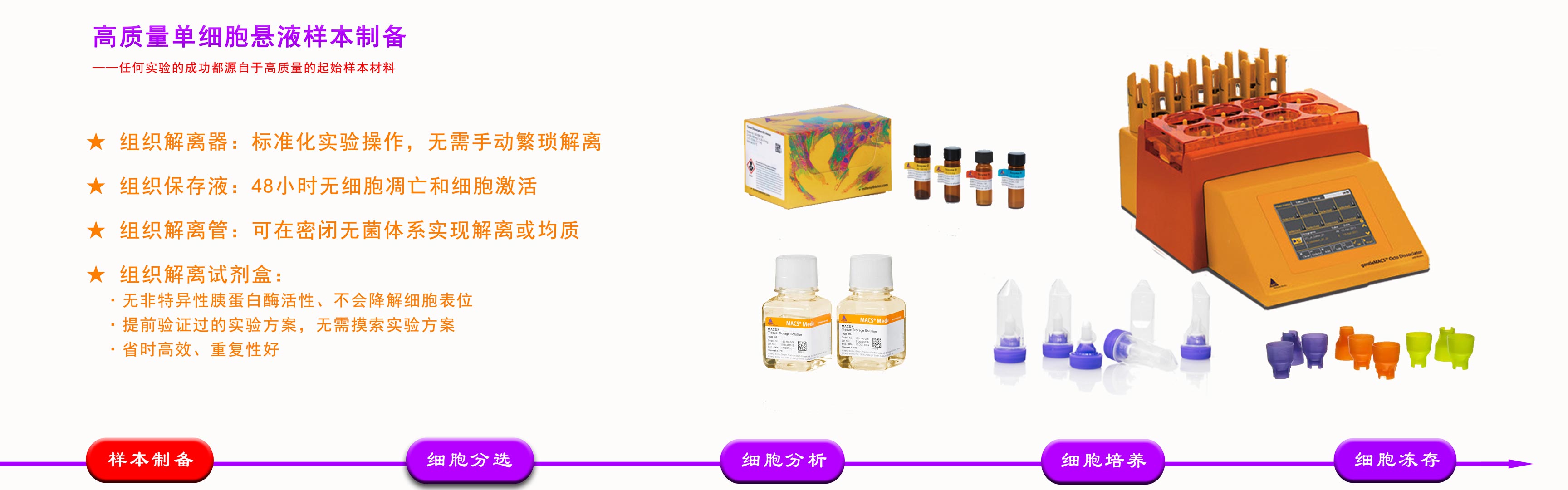
皮肤角质细胞分化并形成角质层,成纤维细胞产生胶原、弹性蛋白和其他多种糖蛋白,赋予皮肤韧度和弹性。皮肤以其结构特性行使屏障使命的同时,给皮肤解离带来了巨大困扰。
培镨生物为您推荐专为人和小鼠皮肤解离开发的试剂盒,满足获取多种皮肤内细胞类型的需求。
| 目的细胞 | 适用试剂盒 | 说明 |
| 获得成纤维细胞和皮肤组成细胞 | 全皮肤解离试剂盒Whole Skin Dissociation Kit, human(130-101-540) | 无需针对真皮和表皮的分离操作,用于从人皮肤活检样本分离成纤维细胞进行培养或用于诱导iPSC,或对皮肤组成的、细胞进行流式分析等下游应用。 |
| 表皮解离试剂盒Epidermis Dissociation Kit ACF, human(130-103-464) | 用于从人皮肤活检样本呢分离角质形成细胞进行原代培养。 | |
|
获取皮肤内免疫细胞 |
表皮解离试剂盒Epidermis Dissociation Kit ACF, mouse(130-095-928) | 用于小数表皮样本分离朗格汉斯细胞用于下游分析。 |
| 多组织解离试剂盒Multi Tissue Dissociation Kits 1(130-110-201) | 用于小鼠全皮肤样本(如耳或背等部位)分离多种免疫细胞(如Treg)用于下游分析。 |
参考文献:【1】 Ali, N. & Rosenblum, M. D. Regulatory T cells in skin. Immunology 152, 372–381 (2017).【2】 Boyman, O. et al. Spontaneous development of psoriasis in a new animal model shows an essential role for resident T cells and tumor necrosis factor-alpha. J. Exp. Med. 199, 731–736 (2004).【3】 Clark, R. A. et al. The vast majority of CLA+ T cells are resident in normal skin. J. Immunol. 176, 4431–4439 (2006).【4】 Malhotra, N. et al. RORα-expressing T regulatory cells restrain allergic skin inflammation. Sci. Immunol. 3, eaao6923【5】 Schenkel, J. M. & Masopust, D. Tissue-resident memory T cells. Immunity 41, 886–897 (2014).【6】 Vincent, M. S. et al. CD1-dependent dendritic cell instruction. Nat. Immunol. 3, 1163–1168 (2002).【7】 Nosbaum, A. et al. Cutting edge: regulatory T cells facilitate cutaneous wound healing. J. Immunol. 196, 2010–2014 (2016).【8】 Schwarz, T. 25 years of UV-induced immunosuppression mediated by T cells-from disregarded T suppressor cells to highly respected regulatory T cells. Photochem. Photobiol. 84, 10–18 (2008).【9】 Stockenhuber, K. et al. Foxp3+ Treg cells control psoriasiform inflammationby restraining an IFN-I-driven CD8+ T cell response. J. Exp. Med. 215, 1987–1998 (2018).
关注培镨生物,了解更多相关知识