发布时间:2024-09-29
病毒感染常是导致免疫缺陷患者致死或致残的主要原因。动物实验及临床研究均已证实病毒特异性T细胞在控制病毒感染中的作用,因此在进行免疫重建及抗感染治疗的研究中得到广泛关注。
有高达三分之一接受异基因造血干细胞移植(allo-HSCT)的患者因免疫功能低下,感染病毒而导致死亡。由于接受HSCT治疗,患者体内的免疫系统在相当长一段时间内将处于空白或功能低下期,即便居住在层流病房内,也有可能出现各类病毒感染并由此导致死亡。
目前,HSCT后病毒感染的治疗主要包括特异性抗病毒药物、免疫治疗、对症治疗等。然而抗病毒药物的种类和疗效仍十分有限,仅于某些类型的病毒感染患者,且有显著的不良反应。抑或利用来自异体干细胞供者的病毒特异性T细胞(virus-specific T cells, VST)重建移植患者的抗病毒免疫。
大量临床试验证明,回输病毒特异性T细胞有可能实现对病毒的快速杀伤,从而达到病毒感染治疗的目的。并且也证明了,此方案对HSCT术后常见的3种病毒(EB病毒(EBV)、巨细胞病毒(CMV)和腺病毒(AdV))感染的预防和治疗是具有疗效的。
病毒特异性T细胞的制备与疗效
病毒特异性T细胞的制备方法通常包括体外扩增与直接分选。体外扩增(ex-vivo expansion)需要较长的细胞生产制备时间,通常伴随着细胞衰竭;且仅能提供有限的供者数量。直接分选 (direct selection)可以快速生产,并允许更多的供者进行HLA匹配。
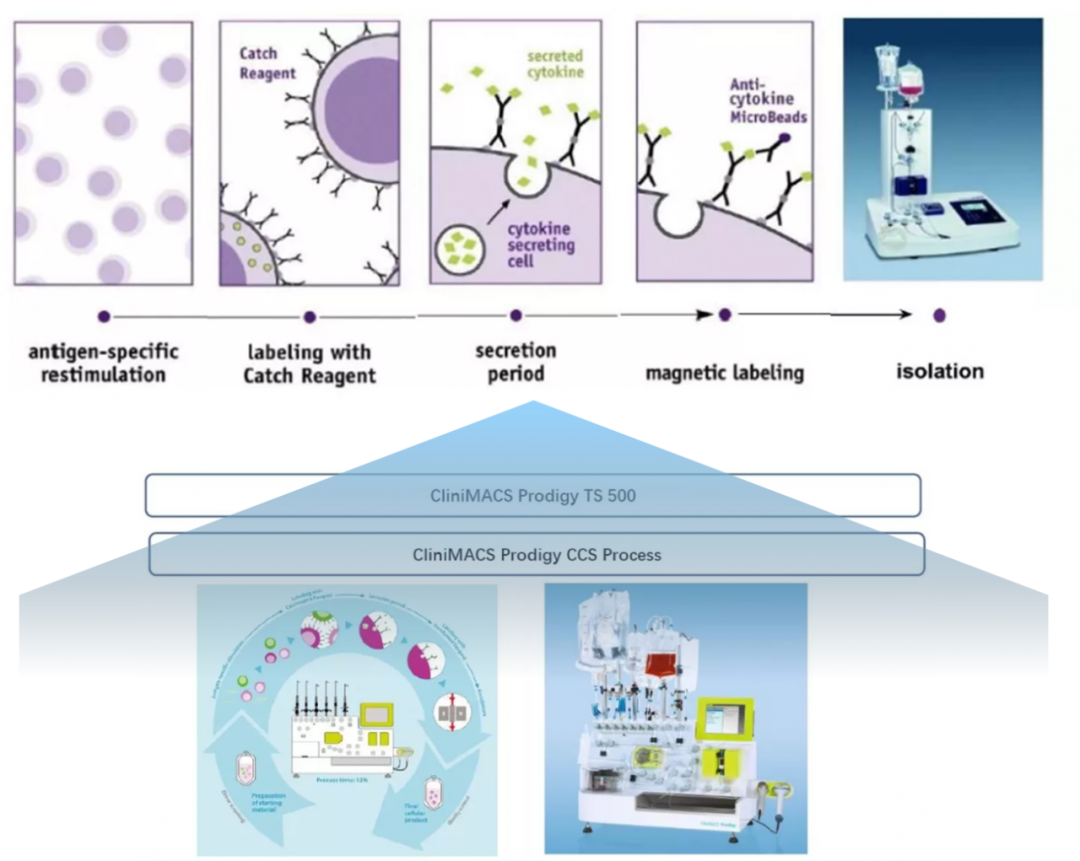
由于病毒特异性T细胞对于复发难治性的病毒感染具有巨大潜力疗效。美国成立了一多中心联合临床试验(IND# 17449),培镨生物代理的美天旎CliniMACS Prodigy®全自动多功能细胞处理系统中的细胞因子捕获系统(CCS-IFN-γ)直接分选病毒特异性T细胞用以回输病毒性免疫陷患者,测试其安全性与有效性。
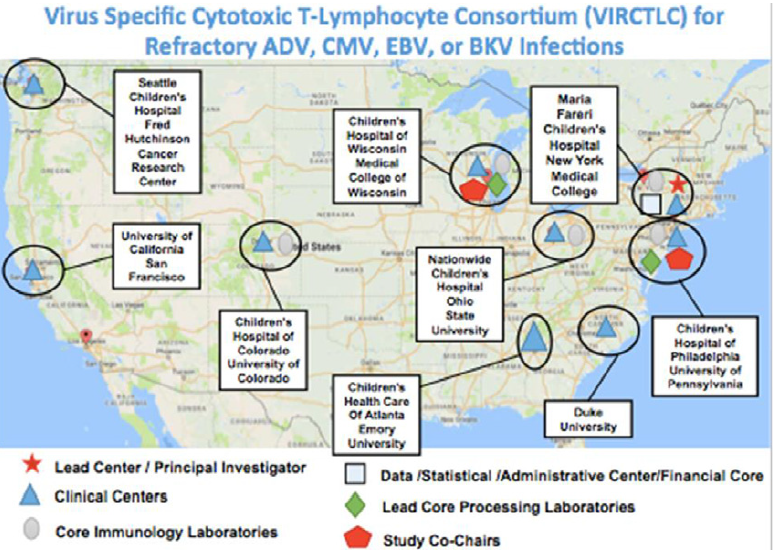
接受临床试验患者包括异基因造血干细胞移植患者(allo-HSCT)、实体器官移植(SOT)以及原发性免疫缺陷病(primary immunodeficiency,
PID),年龄范围介于儿童至青少年间。尽管接受了2周的抗病毒治疗,但仍有难治性ADV、CMV、EBV或BKV感染,和/或对抗生素产生耐药性或不耐受。
VST的制备与回输:
1. 收集符合条件的供者外周血单个核细胞。使用病毒特异性抗原多肽(PepTivator)筛选供者,由此预测是否带有VST,并能成功生产制备。
2. 使用病毒特异性抗原多肽(PepTivator)刺激PBMC ,在利用CliniMACS Prodigy的细胞因子捕获系统 (CCS-IFN-γ)直接分选分离CD4+和CD8+VST。
3. HLA不匹配相关供者的靶细胞剂量为0.5x10^4 CD3+细胞/kg。HLA匹配相关供体的靶细胞剂量为2.5x10^4 CD3+细胞/kg。基于患者回输后反应和
安全性,每2周给予额外剂量的VST,最多5次回输。
VST试验评估初步结果:
13例患者接受了VST输注,其中有10例完全缓解(CR),2例部分缓解(PR),但1例过早评估(ORR 100%,CRR 83%)。达到最大
反应的中位时间为24天。无患者出现GVHD、或细胞因子释放综合征(CRS)。然而1例患者出现急性GVHD复发,可能与VST有关。
细胞因子捕获系统 (CCS-IFN-γ)技术特点和优势
应用CliniMACS Prodigy进行VST具有如下特点:
- 快速:整个流程可以在24小时内完成,尤其利于急性病毒感染的治疗
- 可靠:整个流程全自动化操作,可变因素少,结果可靠
- 方便:全封闭系统制备,最大化减少对操作人员、实验室环境的要求
文献参考:
The Safety and Efficacy of Targeted Virus Specific Cytotoxic T-Lymphocytes (VST) Manufactured By the IFN-g Cytokine Capture System (CCS)
for the Treatment of Refractory Adenovirus (ADV), Cytomegalovirus (CMV), Epstein Barr Virus (EBV) and BK Virus (BKV) in Children,
Adolescents and Young Adults (CAYA) after Allogenic Hematopoietic Stem Cell Transplantation (Allo-HSCT), Solid Organ Transplantation (SOT),
or with Primary Immunodeficiency (PID) (IND# 17449)
关注培镨生物,了解更多相关知识