发布时间:2024-09-29
CAR-T细胞治疗是转基因细胞治疗癌症的一个重要里程碑,随着CAR-T细胞治疗血液恶性肿瘤的巨大成功,开发CAR-NK细胞用于治疗肿瘤与传染性疾病(如
COVID-19)也获得愈来愈多的关注。至今,已有超过19项CAR-NK细胞临床试验正在全球各地进行。NK细胞独特的生物学特性使其成为基因修饰免疫细胞治
疗的一个更具吸引力的来源。
CAR-NK 细胞
优越安全性
与CAR-T细胞相比,未经修饰的NK细胞和CAR-NK细胞免疫治疗的优越安全性已在多个临床研究中得到证实。由于在外周血中循环的CAR-NK细胞寿命有限,
对靶向正常组织或非肿瘤细胞的毒杀风险相对较低。同种异体CAR-NK细胞回输患者亦可降低移植物抗宿主病(GVHD)的风险。细胞因子释放综合征
(CRS)和神经毒性在CAR-NK免疫治疗中发生频率低,部分原因是分泌的细胞因子谱不同:活化的NK细胞通常产生IFN-γ 和GM-CSF,而CAR-T细胞主要
诱导细胞因子,如IL-1a、IL-1Ra、IL-2、IL-2Ra、IL-6、TNF-a、MCP-1、IL-8、IL-10和IL-15,与CRS和严重神经毒性高度相关。
除了以CAR靶向杀死肿瘤靶细胞外,CAR-NK细胞还可以其它方式清除癌细胞。CAR-NK细胞对肿瘤细胞仍具有天然的细胞毒活性,可通过非CAR机制激活,
如NCRs、NKG2D、共刺激受体DNAM-1(CD226)和激活的KIRs(KIR2DS1、KIR2DS4和KIR2DL4)。此外,NK细胞可通过CD16介导的ADCC清除肿瘤细胞。
因此,CAR修饰的NK细胞可以通过CAR依赖和NK细胞受体依赖机制,有效地根除某些肿瘤细胞不表达CAR靶向抗原的异质性肿瘤。
NK 细胞同种异原反应性低
NK细胞的低同种异体反应(alloreactivity)特性,因此不产生GVHD,促使NK细胞/CAR-NK细胞可由多种来源生产制备,包括NK92细胞系、外周血单个核细胞
(PBMCs)、脐带血(UCB)和诱导多能干细胞(iPSC)。例如NK92细胞为临床应用提供了一种“即用型”(off-the-shelf)的CAR修饰细胞产品。而来源于转基
因修饰的iPSC衍生CAR-NK细胞可以以同质性高和临床应用等级方式生产,并已在临床前动物实验证明了强大的抗肿瘤活性和增殖能力。因此,CAR-NK细胞
可以提供“即用型”的产品,消除了目前困扰CAR-T细胞个性化疗法和针对患者特异性的产品需求。
CAR-NK细胞的制备
NK细胞来源
NK92细胞作为肿瘤细胞株有固有的缺陷,包括潜在的致瘤性风险,缺乏CD16和NKp44的表达,以及由于在输注前需要辐照因而丧失体内扩张潜力,使其不太
可能成为CAR-NK细胞治疗方法的理想细胞源。
利用临床级磁珠 (CliniMACS CD56/CD3 Reagents, Miltenyi Biotec)可直接从供者外周血单个核细胞(PBMCs)或脐带血(UCB)中分离原代NK细胞。分离的原代NK细胞可以被激活,再经慢病毒(LV)或逆转录病毒(RV)转导进行基因工程改造表达CAR,然后在NK细胞专一性扩增培养基(如 NK MACS Medium, Miltenyi Biotec)中利用细胞因子进行扩增,以实现GMP级临床应用。PBMCs来源的NK(PB-NK)细胞,其中高达90%是CD56dimCD16+NK细胞,通常表现出成熟的表型,细胞毒性增加,增殖能力降低。由于缺乏GVHD,可以从匹配或HLA不匹配的供体中分离出PB-NK细胞,提供了更多的供体选择,从而提高了最终产品的质量。脐血库也可提供选择具有特定HLA类型和特异性NK受体谱的供体优势。然而,由于UCB数量有限,因此获得足够数量的UCB-NK细胞用于临床是主要障碍。同时,与PB-NK细胞相比,UCB-NK细胞表现出较不成熟的表型和较低的细胞毒性。此外,PBMC和UCB衍生的CAR-NK细胞并非同质来源,使产品标准化变得困难。
CD34+造血祖细胞(HPCs)诱导NK细胞分化是获得大量成熟NK细胞用于临床应用的另一途径。CD34+HPCs可以从骨髓、胚胎干细胞、动员的PB或UCB中分离出来,然后在培养系统中使用混合细胞因子扩增和分化为成熟的NK细胞。由此产生的CD56+CD3-NK细胞与PB-NK细胞基本相似,表达活化的NK细胞受体,在体内外对白血病细胞表现出较强的细胞毒性。
诱导多能干细胞(iPSCs)由于其无限增殖能力,亦已成为“即用型”CAR-NK细胞产品的另一吸引力来源。iPSCs可分化为CD34+HPCs和NK细胞。重要的是,可以对iPSCs进行基因工程改造表达CAR,然后将其分化为CAR-HPCs,最后分化为CAR-NK细胞。所得到的CAR-NK细胞可在辐照后表达mIL-21的人工抗原呈递细胞的存在下扩增和收获。在这个过程中,仅需一个带有CAR修饰的iPSC就足以分化成大量高度同质的CAR-NK细胞产品,供临床使用。然而,iPSCs来源的NK细胞与UCB-NK细胞相似,通常表现为不成熟的表型,与PB-NK细胞相比,KIR和CD16的表达较低,NKG2A的表达更高。尽管如此,iPSC衍生的CAR-NK已在体外和体内展示了强大的抗肿瘤活性,因此为“即用型”的CAR-NK细胞产品提供了一种可再生的来源。
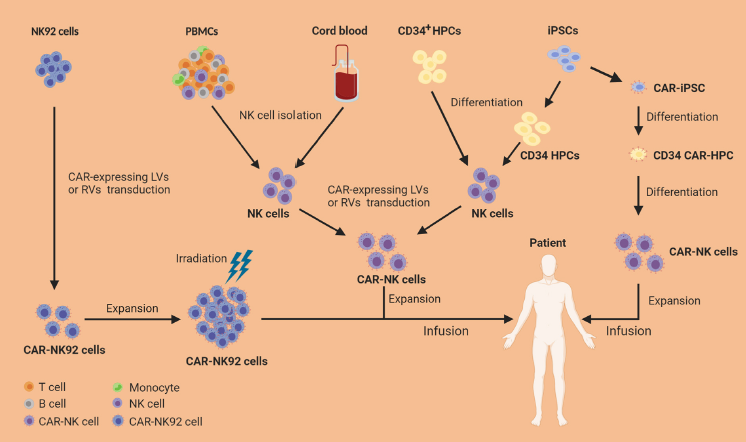
CAR-NK细胞来源
CAR表达载体建构
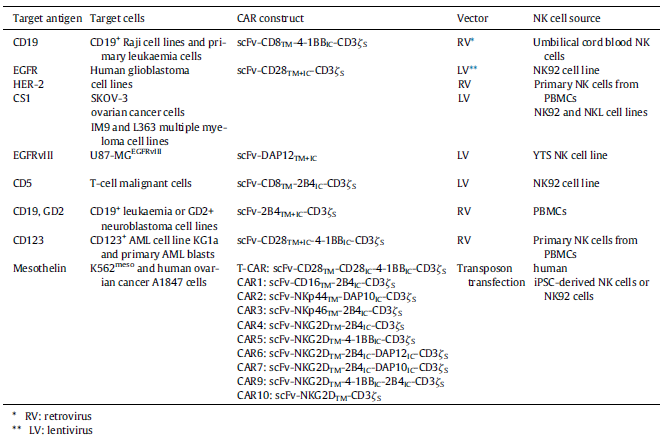
目前大多数的CAR-NK细胞研究使用为CAR-T细胞设计的CAR表达载体,近来已有专门为NK细胞设计了新型的CAR结构。然而,这些不同的CAR结构对NK细胞
的细胞毒性和细胞因子的产生有不同的影响。下表总结了目前在CAR-NK细胞中使用的不同CAR结构的成分,其中一种含有4-1BB共刺激结构域的第二代抗
CD19-CAR(scFv-CD8TM-4-1BB-CD3ζ)可在原代NK细胞中表达,诱导NK细胞特异性杀伤CD19+急性淋巴细胞白血病(ALL)。还开发了含有CD28共刺激结
构域的CAR结构直接对抗HER2、EGFR或EGFRvIII和CS1。虽然这些最初用于T细胞的含4-1BB/CD28的CARs在NK细胞中可发挥抗肿瘤活性,但据报道含有
2B4(NK特异共刺激结构域)的NK细胞对肿瘤细胞具有显著增强的细胞毒性。与传统含4-1BB的CAR转染的NK细胞相比,细胞因子生成增加,细胞凋亡减少,
表明NK细胞特异性激活信号影响CAR的性能。为了优化NK细胞的CAR结构,发现带有NKG2DTM结构域和2B4共刺激结构域,抗肿瘤活性的增加幅度最大。改
善这些NKG2DTM和2B4的细胞活性的一个可能的机制是它们在高间皮素刺激条件下,通过补充内源性DAP10激活信号的能力。
率在27%-52%之间。然而,逆转录病毒转导后导致的插入突变和对原代NK细胞活性的有害影响是这种方法在临床应用中的一些主要局限性。
与逆转录病毒载体相比,慢病毒(LV)载体具有较低的遗传毒性和插入突变作用,是一较安全的选择。但慢病毒在原代NK细胞中的转导效率较低,往往需要多轮
的转导。最近,研究报道用改良后的BaEV-gp假型慢病毒载体比VSV-G假型慢病毒载体具有20倍或更高的转导效率。用这种转导方法,CD19-CAR在来自不同供
体的人原代NK细胞中平均表达70%,且这些CD19-CAR NK细胞能有效且特异地杀死CD19阳性肿瘤细胞。
DNA转座子是一种可移动的DNA元件(DNA elements),通过“剪切-粘贴”机制在载体和染色体之间进行有效的转座;PiggyBac(PB)和Sleeping Beauty(SB)是
目前最常用的两种转座子系统。通过将含CAR的质粒与转酶DNA联合转染iPSCs,生成稳定表达CAR分子的CAR-iPSC-NK细胞。与病毒载体相比,这些转座子系统
具有免疫原性低、生物安全性高、生产成本低、可转化大基因片段 (>100kb)等优点,使其成为一个具有吸引力的基因转导系统,使外源CAR插入NK细胞基因组
并持久的表达。然而,转座子系统在原代NK细胞转导中的适用性仍有待进一步改进,需克服质粒DNA电穿孔对NK细胞的低转导效率和细胞病变等障碍。
CRISPR/Cas9技术是一种靶向性很强的基因整合技术,利用引导RNA(guide RNA)将Cas9核酸酶导入靶位点,产生双链断裂,然后通过同源定向重组,在基因组的
特定位点诱导永久性修饰。CRISPR/Cas9已被用来替代T细胞中的内源性TCR位点,从而产生异基因通用的CAR-T细胞。在NK细胞中,CRISPR/Cas9系统可通过靶
向CAR插入、稳定敲除或整合与NK细胞耗竭、活化、耐受或记忆相关的基因来增强NK细胞的抗肿瘤功能。
CAR-NK细胞体外扩增
NK细胞在外周血中所占比例很低(5-15%),因此在用于过继性免疫治疗之前,有必要对其进行扩增。多种细胞因子如IL-2、IL-15、IL-12、IL-21和IL-18,已被
用于体外扩增原代NK细胞。然而,由这些细胞因子诱导的NK细胞体外增殖一般是有限的。与刺激性细胞(如Wilms肿瘤细胞系、自体PBMCs、EBV转化的淋巴母
细胞、慢性粒细胞白血病细胞系K562细胞)共培养可诱导NK细胞快速而持续的增殖。此外,同时表达mIL-15和4-1BBL的K562细胞刺激了更有效的NK细胞扩增,
这已经用于产生大量临床级NK细胞。然而,这些饲养细胞激活的原代NK细胞在持续增殖一段时间,最终会对刺激无反应导致衰老(senescence)。此外,在与NK
细胞共培养前,必须对K562饲养细胞进行致死性辐照,以确保最终产品中检测不到增殖和有活力的饲养细胞。这也对细胞生产供临床应用多一道检测手续,检
测饲养细胞残留性。
基因改造表达mIL-15的NK细胞具有更高的增殖和存活率,对肿瘤细胞具有更高的细胞毒性。mIL-15提供的顺式刺激 (cis stimulus)甚至优于K562饲养细胞上表达
mIL-15的反式刺激(trans stimulus)。由于NK细胞自分泌mIL-15,可使NK细胞治疗无需外源性细胞因子介导的潜在不良反应。此外,研究报道了使用用IL-12、
IL-15和IL-18的细胞因子组合进行短暂的预激活(12-16h)可诱导记忆样NK细胞(memory-like NK cells)。一期临床试验的数据表明,细胞因子诱导的记忆样NK
细胞在AML患者的过继转移后表现出明显的扩增和强烈的抗白血病反应,这表明将CAR引入这些记忆样NK细胞可能是NK细胞介导的癌症治疗的一种有前途的方法。
即用型CAR-NK细胞 未来前景可期
CAR-NK细胞作为一种新型的肿瘤细胞免疫治疗有着巨大的应用前景,并且产生即用型的、安全的临床应用产品。日新月异的基因工程改造技术可使新型的CAR-NK
细胞产物具有强大的抗肿瘤活性,但在输注到患者体内后仍对正常组织无毒。随着临床前研究和临床试验的安全性和有效性应证,预计CAR-NK细胞疗法将继续发展,
使癌症患者的生存率显著提高。
参考文献:
CAR-NK cells: A promising cellular immunotherapy for cancer. EBioMedicine. 2020 Aug 24;59:102975. doi:10.1016/j.ebiom.2020.102975.
关注培镨生物,了解更多相关知识