发布时间:2024-09-19
自然杀伤(NK)细胞具有多种细胞毒性机制,同时能够分泌细胞因子调节免疫反应,在抗肿瘤免疫中发挥关键作用。基于NK细胞的过继性细胞疗法展现了良好的潜力,目前NK细胞疗法的开发策略聚焦于通过共刺激信号、检查点抑制和细胞因子“装甲”来增强NK细胞的效力和持久性,以及通过表达CAR或使用engager分子来将NK细胞特异地导向肿瘤[1]。
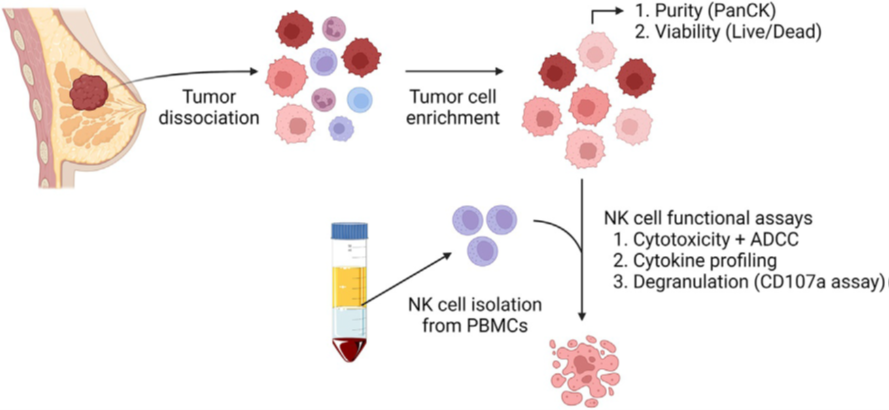
在前期研究的NK细胞功能试验中,使用来自患者的原代肿瘤细胞,能够体现肿瘤细胞系所缺乏的体内肿瘤微环境和原发肿瘤异质性的影响。在此,培镨生物编译了荷兰Maastricht大学医学中心用于监测NK细胞对来自人肿瘤的原代乳腺癌细胞效应功能的体外细胞模型,包含从原代细胞制备到功能检测的完整实验方案[2]。
目录:
-
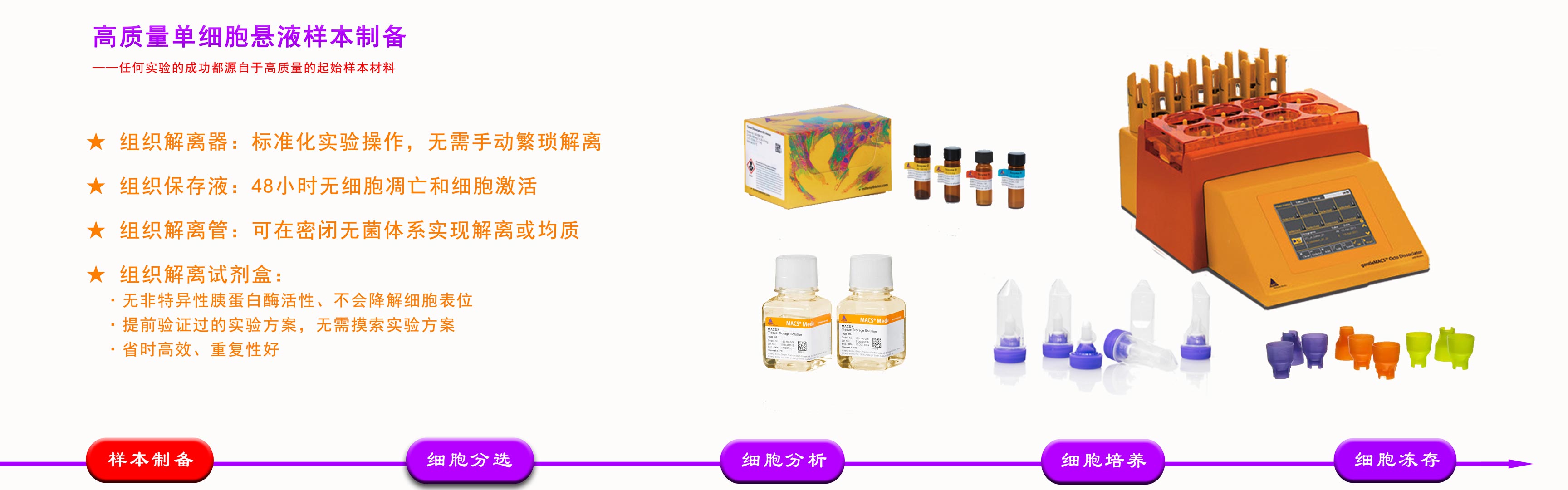
主要试剂
-
材料与设备
-
准备工作
-
操作步骤
-
预期结果
-
定量与统计分析
1、主要试剂:
试剂
品牌及货号
MACS Tissue Storage Solution
Miltenyi Biotec, 130-100-008
Tumor Dissociation Kit, human
Miltenyi Biotec, 130-100-008
Tumor Cell lsolation Kit, human
Miltenyi Biotec, 130-108-339
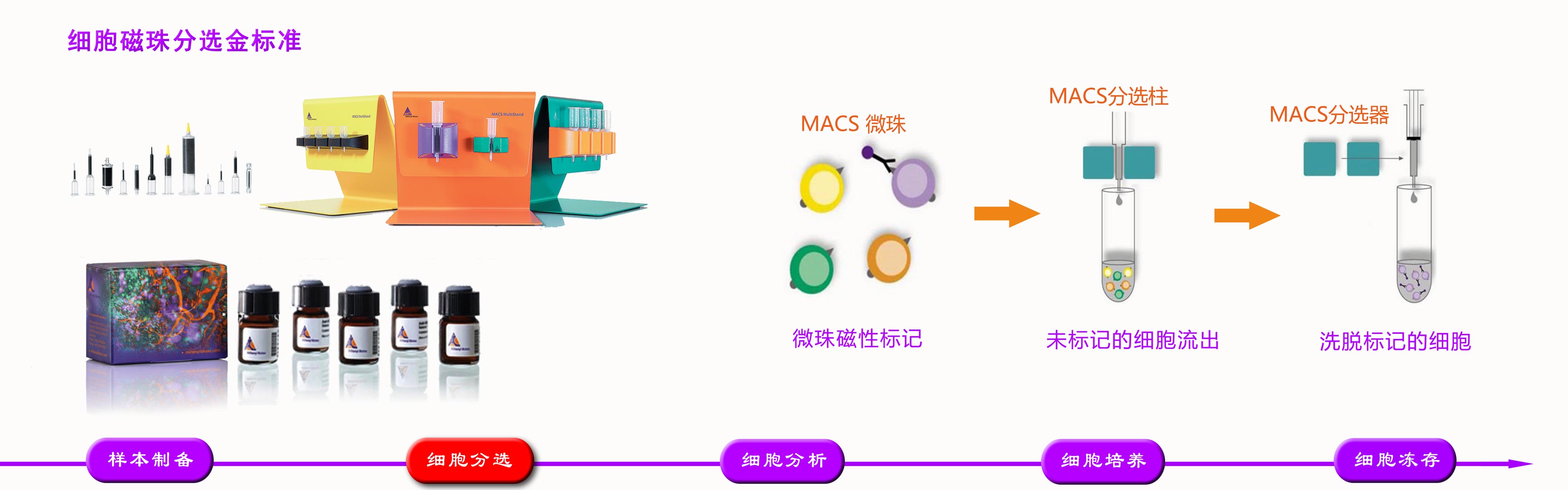
NK Cell lsolation Kit, human
Miltenyi Biotec,130-092-657
Cytofix/CytopermTM Fixation/Permeabilization Kit
BD Biosciences,554714
Protein Transport Inhibitor (containing Monensin)
BD Biosciences, 554724
抗体
Cytokeratin Pan Monoclonal Antibody (C-11). AlexaFluorTM 488
Invitrogen,MA5-18156
LIVE/DEADTM Fixable Aqua Dead Cell Stain Kit
Invitrogen, L34966
CD107a(LAMP-1) Antibody, anti-human, VioBlue®(H4A3)
Miltenyi Biotec, 130-119-873
lsotype Control Antibody, mouse lgG1(1S5-21F5)
Miltenyi Biotec, 130-094-670
CD56 Antibody, anti-human, PerCP-Vio® 700,REAfinityTM (REA196)
Miltenyi Biotec,130-114-551
CD3 Antibody, anti-human, APC-Vio® 770
Miltenyi Biotec.130-113-688
流式补偿微球
Miltenyi Biotec.130-113-688或BD Biosciences, 552843
以及PBS 1×,人血清白蛋白(HSA),RPMI-1640(1×)+GlutaMAX,热灭活胎牛血清(FCS),青霉素-链霉素(10000U/mL)(P/S),200mM EDTA,NaN3。
2、材料与设备
-
gentleMACS组织解离器,gentleMACS C管(Miltenyi Biotec)
-
100μm和70μm细胞滤筛
-
试管混悬仪,CO2培养箱,带摆动转子的低温离心机,633/405/488nm激光的流式细胞仪
-
15mL和50mL离心管,96孔细胞培养板,移液器及移液吸头
时间:5h
a. 按Miltenyi产品说明书,准备Tumor Dissociation Kit的酶。
b. 用于富集肿瘤细胞的分离缓冲液:PBS/0.5% HSA。
c. 按BD Biosciences产品说明书,准备胞内染色缓冲液:用双蒸水稀释Permeabilization/Wash buffer 10×到1×,自带的稀释液将Fixation/Permeabilization buffer 4×稀释到1×。
d. 流式缓冲液:PBS/1% FCS/0.02% NaN3。
e. 培养基:RPMI/10% FCS/1% P/S。
f. EDTA/PBS缓冲液:PBS/2mM EDTA。
g. MACS缓冲液:PBS/2mM EDTA/0.5% HSA,4°C。
h. 采集乳腺癌组织样本,立即转移至MACS Tissue Storage Solution,可在4°C保存48h。
4、操作步骤4.1 解离乳腺癌组织为单细胞悬液并富集肿瘤细胞
时间:4h
4.1.1 肿瘤样本处理(按照Miltenyi“Tumor Dissoication Kit, human”方案)
1.在生物安全柜中操作,尽可能保持无菌。
2.取培养皿加入足量RPMI,称重,移入组织,避免组织干燥。
3.再次称重培养皿,两次称重差值为组织重量。
注:下文的试剂量适用于最多1g组织,当处理更多组织时按比例调整用量。
4.用手术刀将肿瘤组织尽可能切成小块。
5.转移组织块和RPMI至C管。
6.用1-2mL RPMI洗培养皿,合并至C管。
7.对最多1g组织,向C管加入4.7mL RPMI,200μL Enzyme H,100μL Enzyme R和25μL Enzyme A。
8.关紧C管,倒置,安装到gentleMACS组织解离器。
注:如使用gentleMACS Octo带加热模块组织解离器,步骤9-12替换为产品说明书中操作步骤。
9.运行程序h_tumor_01。
10.取下C管,置于试管混悬仪上37°C旋转30min。
11.重复步骤8-10。
12.将C管安装到gentleMACS组织解离器上,运行程序h_tumor_01。
13.取100μm细胞滤筛置于新的50mL离心管上,过滤细胞悬液。
14.捣碎残留的肿瘤碎片以通过滤筛,可使用注射器的活塞。
15.用5-10mL RPMI洗涤C管和细胞滤筛。
16.取70μm细胞滤筛置于新的50mL离心管上,过滤细胞悬液。
17.室温280×g离心8min,最高加速度(ac=9)和最高减速度(dc=9)。
18.小心地弃去上清,如使用血清学吸管。
19.1mL RPMI重悬。
20.细胞计数,如使用血球计数板。
21.继续富集肿瘤细胞,细胞悬液室温280×g离心8min(ac=9,dc=9)。
22.重悬细胞,60μL分离缓冲液最多1×10^7总细胞。
23.对最多107总细胞,加入20μL Non-Tumor Cell Depletion Cocktail A和20μL Non-Tumor Cell Depletion Cocktail B。
24.涡旋3s混匀,4°C孵育15min。
25.孵育的同时准备分选柱,将LS柱置于MACS分选器磁场中,加3mL分离缓冲液润洗。
26.孵育完成后,用分离缓冲液调整细胞悬液体积至500μL。
27.加细胞悬液至分选柱,每根LS柱最多4×10^7总细胞。
28.收集流穿液,含有富集的未标记的肿瘤细胞。
29.加1mL分离缓冲液清洗分选柱两次,收集流穿液合并至同一离心管。
30.(可选)收集标记细胞:从分选器移出分选柱,置于新的离心管上,加3mL分离缓冲液,立即用力推活塞,将柱上标记的非肿瘤细胞冲下。
31.细胞悬液室温280×g离心8min(ac=9,dc=9)。
32.小心地弃去上清,根据沉淀量重悬于0.5mL或1mL培养基。
33.细胞计数。
4.1.2 评估肿瘤细胞的活率和纯度
34.调整细胞浓度,按20000个肿瘤细胞/100μL加至96孔圆底板。
注:每个条件均设置重复。
35.96孔板4°C 787×g离心3min(ac=9,dc=9)。
36.脉冲涡旋沉淀。
37.向细胞加入200μL PBS。
38.4°C 787×g离心3min(ac=9,dc=9),弃上清,脉冲涡旋。
39.用PBS稀释Live/Dead Aqua到1×,即每999μL PBS加1μL Live/Dead Aqua。
40.每孔加25μL Live/Dead Aqua 1×。
41.4°C孵育30min。
42.加200μL PBS洗涤。
43.4°C 787×g离心3min(ac=9,dc=9),弃上清,脉冲涡旋。
44.每孔加200μL Fixation/Permeabilization buffer。
45.2-8°C孵育30-60min,避光。
46.4°C 787×g离心3min(ac=9,dc=9),弃上清,脉冲涡旋。
47.每孔加200μL Permeabilization buffer,4°C 787×g离心3min(ac=9,dc=9),弃上清,脉冲涡旋。
48.重复步骤47。
49.每孔加100μL Permeabilization buffer。
50.用Permeabilization buffer稀释PanCK抗体。
51.加入适量直标抗体检测胞内抗原,4°C孵育30min,避光。
注:作者使用每孔25μL 1:500稀释的PanCK-AF488抗体。
52.每孔加100μL Permeabilization buffer,4°C 787×g离心3min(ac=9,dc=9),弃上清,脉冲涡旋。
53.重复步骤52。
54.加200μL流式缓冲液重悬染色的细胞,流式细胞仪检测分析。
4.2.1 分离PBMC
55.此处操作省略,可使用金准的梯度密度分离液(LBS1077)搭配梯度密度分离管(601050)从50mL外周血分离PBMC。
56.得到的PBMC检查是否有血液团聚物,如有,用70μm滤器过滤,2mM EDTA/PBS洗涤,室温离心。
57.检查是否有红细胞,如有,用红细胞裂解液裂解,2mM EDTA/PBS洗涤,室温离心。
58.用MACS缓冲液重悬,计数细胞。
4.4.2 从PBMC阴性选择分离NK细胞(按照Miltenyi“NK Cell Isolation Kit, human”方案)
59.加入MACS缓冲液至50mL。
60.室温280×g离心8min(ac=9,dc=9)。
61.按每107细胞40μL重悬于预冷的MACS缓冲液。
62.4°C孵育5min。
63.每10^7细胞加10μL抗体。
64.涡旋3s混匀。
65.4°C孵育5min。
66.每107细胞加入20μL α-生物素磁珠和30μL MACS缓冲液。
67.涡旋3s混匀。
68.4°C孵育10min。
69.加入10到20倍反应体积的MACS缓冲液,洗涤细胞和磁珠。
70.室温280×g离心8min(ac=9,dc=9)。
71.离心同时,取一个预分选滤器置于LS柱顶部,加3mL MACS缓冲液润洗。
72.离心后,重悬细胞,按500μL MACS 缓冲液/LS柱/1×108细胞。
73.放置新收集管,收集流穿液,即NK细胞。
74.吸取500μL细胞至滤器(每根LS柱最多1x108细胞)。
75.加3mL MACS缓冲液洗涤分选柱三次。
76.室温280×g离心8min(ac=9,dc=9),弃上清。
77.用培养基重悬细胞并计数。
78.得到的NK细胞用于功能试验(见4.3部分)。或按1-2×106细胞/mL,在培养基中添加500-1000U/mL IL-2,37°C,21%O2 5%CO2,过夜(>16h)培养,激活NK细胞。
注:可用流式细胞术评估分离的NK细胞纯度,CD56+CD3-为NK细胞,CD56+CD3+为NKT细胞。
参考文献
[1] Laskowski TJ, Biederstädt A, Rezvani K (2022) Natural killer cells in antitumour adoptive cell immunotherapy. Nature Review Cancer 22: 557-575.
[2] Beelen NA, Ehlers FAI, Kooreman LFS, Bos GMJ, Wieten L (2022) An in vitro model to monitor natural killer cell effector functions against breast cancer cells derived from human tumor tissue. Methods in Cell Biology doi.org/10.1016/bs.mcb.2022.05.001
关注培镨生物,了解更多NK细胞相关知识