发布时间:2024-09-20
承接上文
4.3 NK细胞对人原代乳腺癌细胞的功能试验
4.3.1 NK细胞细胞毒性试验
时间:4h+16h孵育
79.按20000个肿瘤细胞/100μL加至96孔圆底板,每个条件均设置重复,设置自发肿瘤细胞死亡的对照孔(只有肿瘤细胞不加NK细胞)。
注:建议设置易被NK细胞杀伤的阳性对照,如K562细胞系。细胞毒性试验可与单抗结合,预孵育肿瘤细胞和抗体触发抗体依赖的细胞毒性(ADCC)。
80.如下表,用培养基调整NK细胞浓度获得合适的E:T比:
81.转移不同浓度的NK细胞各100μL至相应的肿瘤细胞孔中。
82.37°C培养箱,21%O2 5%CO2,培养16h。
83.取出细胞培养板,放冰上。
84.4°C 787×g离心3min(ac=9,dc=9),弃上清,脉冲涡旋。
85.加200μL PBS。
86.4°C 787×g离心3min(ac=9,dc=9),弃上清,脉冲涡旋。
87.用PBS稀释Live/Dead Aqua到1×,即每999μL PBS加1μL Live/Dead Aqua。
88.每孔加25μL Live/Dead Aqua 1×。
89.4°C孵育30min。
90.200μL PBS洗涤。
91.4°C 787×g离心3min(ac=9,dc=9),弃上清,脉冲涡旋。
92.对于PanCK胞内染色,重复步骤44-53。
93.加200μL流式缓冲液重悬染色的细胞,流式细胞仪检测分析。
注:用200μL 1%PFA重悬固定细胞可以稍后再进行流式分析(染色之后最长4天)。
4.3.2 (可选)细胞分泌谱评估,即细胞因子检测
94.NK细胞细胞毒性试验之后可以收集上清液,将96孔板在4°C 787×g离心3min(ac=9,dc=9),小心吸取上清液,不要扰动沉淀,-80°C贮存。可以使用市面上的细胞因子检测试剂检测肿瘤细胞暴露后NK细胞的分泌谱。
注:细胞因子检测不能与CD107a试验一起进行,因为后者使用的Golgi Stop含有阻断胞内蛋白运输的Monensin。
4.3.3 NK细胞对原代乳腺癌细胞的脱颗粒(CD107a)试验
时间:4h+4h孵育
95.用培养基将NK细胞和肿瘤细胞的浓度都调整至1×106细胞/mL。
96.根据实验设置,每孔加100μL NK细胞悬液,即1×105细胞。
97.根据实验设置,每孔加100μL肿瘤细胞悬液,即1×105细胞。
98.对所有条件用培养基准备CD107a或同种型对照抗体混合液:
a. 每孔:5μL CD107a Horizon V450抗体+20μL培养基。
b. 每孔:0.5μL IgG1κ V450+24.5 μL培养基。
99.根据实验设置,向NK-肿瘤悬液直接加25μL CD107a抗体混合物或同种型对照混合物。
100.用培养基稀释BD Golgi Stop 10×至1×。
101.37°C孵育1h。
102.每孔加6μL稀释得到的BD Golgi Stop 1×,37°C再孵育3h。
103.取出培养板,放冰上。
104.转移细胞至96孔深孔板,在冰上进行流式染色。
105.向深孔板中的细胞加200μL PBS。
106.4°C 787×g离心3min(ac=9,dc=9)。
107.小心地弃去上清。
108.用PBS稀释Live/Dead Aqua到1×,即每999μL PBS加1μL Live/Dead Aqua。
109.每孔加25μL Live/Dead Aqua 1×。
110.4°C孵育30min。
111.400μL PBS洗涤。
112.4°C 787×g离心3min(ac=9,dc=9)。
113.小心地弃去上清。
114.按下表,每孔加入50μL抗体混合液:
115.重复步骤110-113。
116.加200μL流式缓冲液重悬染色的细胞,流式细胞仪检测分析。
注:用200μL 1%PFA重悬固定细胞可以稍后再进行流式分析(染色之后最长4天)。与细胞毒性试验类似,脱颗粒试验建议设置阳性对照,并可与触发ADCC的单抗结合。
6. 定量与统计分析
6.1 NK细胞细胞毒性试验
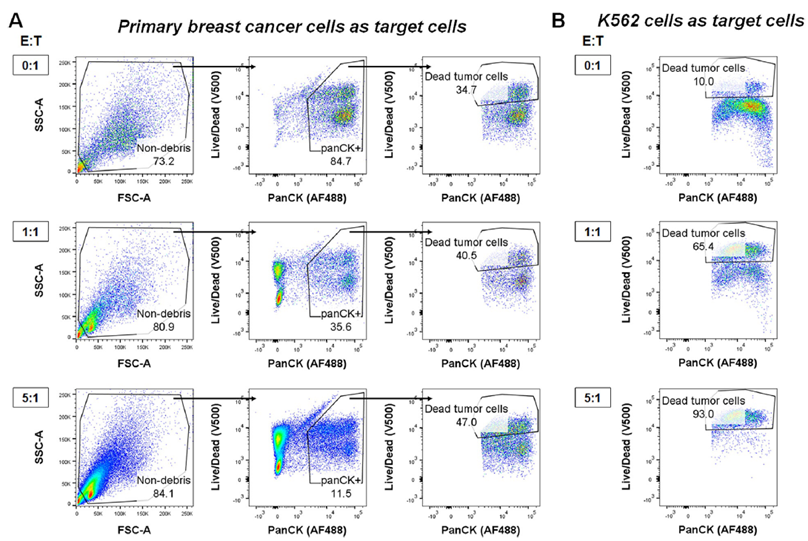
NK细胞介导的细胞毒性计算为Live/Dead+肿瘤细胞(PanCK+)百分比。为了计算特异的细胞毒性,需要对自发的肿瘤细胞死亡进行校正。
6.2 NK细胞CD107a试验
NK细胞脱颗粒计算为总NK细胞(CD56+CD3-)中的CD107a+细胞百分比。NK细胞在肿瘤暴露后的脱颗粒应该对“仅NK”条件下的自发脱颗粒进行校正。
细胞毒性试验的圈门策略[2]
脱颗粒(CD107a)试验的圈门策略[2]
参考文献
[1] Laskowski TJ, Biederstädt A, Rezvani K (2022) Natural killer cells in antitumour adoptive cell immunotherapy. Nature Review Cancer 22: 557-575.
[2] Beelen NA, Ehlers FAI, Kooreman LFS, Bos GMJ, Wieten L (2022) An in vitro model to monitor natural killer cell effector functions against breast cancer cells derived from human tumor tissue. Methods in Cell Biology doi.org/10.1016/bs.mcb.2022.05.001
关注锫镨生物,了解更多NK相关知识